반응형
안녕하세요! 공돌이 인생무상입니다. 이번 편에서는 드디어 Fe - C 상태도를
제대로 분석해보도록 해봅시다!
** 본 포스팅은 Fundamentals of materials science and engineering( William D Callister 외 1인 저) 책에서 이미지를 가져왔습니다.
Fe - C 상태도란?

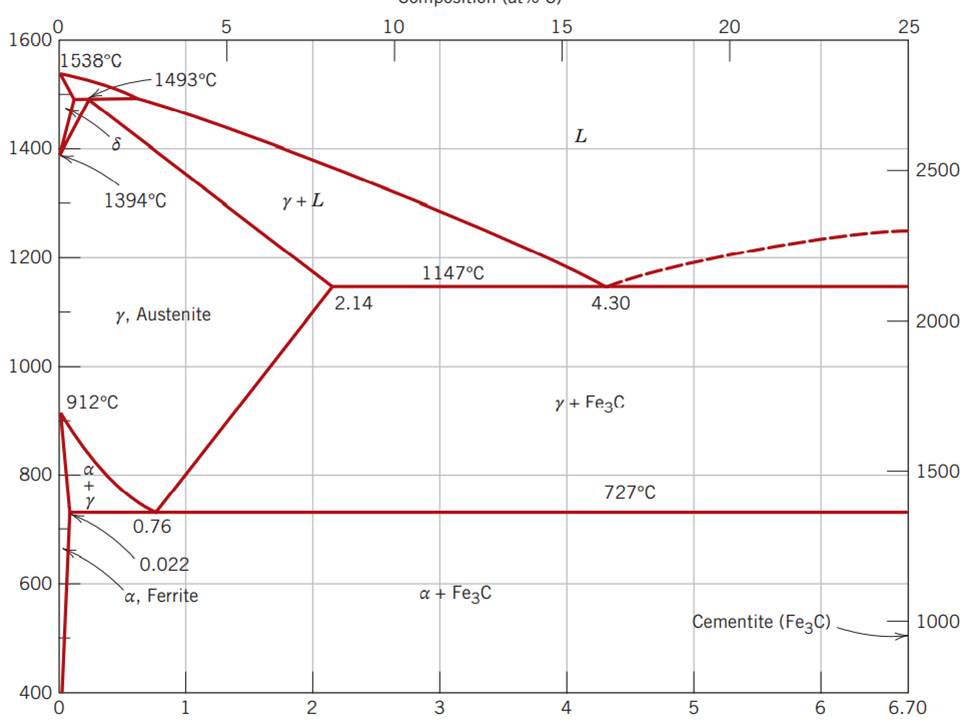
바로 이 그림이 Fe - C 상태도입니다. 뭔가 많이 복잡해보이죠? 허허..그렇죠.
고등학생 시절, 대학교 교양 과학에서도 안나온 형태의 그래프인데...
하지만 내용을 알고나면 그렇게 어렵지 않다는 것!
표의 가장 기본이 되는 축 방향에 대해서 설명드리면, X 축은 철과 탄소
혼합물의 탄소 비율을 표시하는 축이고 y 축은 철과 탄소 혼합물의 온도를
표시한 것입니다. 강은 탄소 함유량이 0.03 ~ 2% 까지인 영역이니까 고 부분만 보면 될 것입니다. 나머지는 주철 영역이므로 주철 영역에 대해선 따로 다시 공부해보도록 합시다!
x, y 축에 대한 설명과 함께 용어도 같이 간략하게 설명하면 좋을 것 같네요.
L : 액체 상태의 철과 탄소 혼합물
δ : δ 철이라고 불리는 상태의 철. 순수한 철이며 고온에서만 발생하는 철
γ : γ 철, 오스테나이트라 불리는 조직.
α : α 철, 페라이트라 불리는 조직.
Fe3C : 시멘타이트라 불리는 조직
철 조직은 각각 이름이 다르게 불리는데, 그 각각의 성질이 다르기 때문입니다.
이 그림은 다음과 같이 두 가지 영역으로 쪼개보면 쉽게 이해가 될 겁니다.
왜 넓은 범위 중 두 영역만 설명하느냐? 강은 탄소 함유량이 2%인 부분까지이니까 여기 까지만 알아두면 되는 것입니다.

위 그림처럼 표시된 두 영역을 가지고 설명하면 좋을 것 같네요. 우선 첫 번째 영역에 대한 설명을 하려고 합니다. 요약부터 먼저 말씀드리면...
- ① 영역에 대한 요약 -
x 축 ( 탄소 함량) : 0~ 0.03% 사이
철의 녹는점에 다다르는 수준의 높은 온도의 영역
δ 철 영역은 공학적으로 크게 의미있는 영역은 아님.
그럼 이제 자세한 설명을 해봐야겠네요!

우선 ① 영역을 확대하면 위 그림과 같고요. 녹색으로 표시된 영역은 δ 철 영역이라하며 공학적 관점에서는 큰 의미가 없는 영역입니다. 왜? 저 영역은 고온에서만 존재하는 영역입니다. 우리가 쓸 철 - 탄소 혼합물은 실온에서 쓰일거잖아요? 실온으로 가면서 저 영역.. 그러니까 δ 철은 이미 다른 물질로 변해버렸기 때문에.. 실온에 쓰이는 철 - 탄소 혼합물은 아니며, 그렇기 때문에 공학적으로 의미가 없는 것이지요.
그리고 이 영역의 철에 들어있는 탄소의 함량은 전체 중량의 0~0.03% 정도 섞여 있습니다. 온도가 높은 순수한 철이며 , 온도가 낮더라도 순수한 철은 공학 재료로 거의 쓰지 않습니다.
δ 철 영역의 오른쪽 위쪽은 δ 철과 액체가 섞여있는 영역이고요. 오른쪽 아래는
δ 철과 γ 철이 섞여 있는 영역입니다.
δ 철에 대해 간략히 설명을 드렸으니, 이제부터 중요해질 γ 철 영역에 대해서 설명해보겠습니다. 이 부분은 굉장히 중요한 부분이니 꼭 여러번 읽어보시고 확실히 이해해주시길 바랍니다!
- ② 영역에 대한 요약 -
x 축 ( 탄소 함량) : 0.03~ 2.00% 사이
이 영역은 탄소 함유량 0.76%가 가장 중요한 부분 (공석 반응 지점)
0.76%, 0.022%~0.76%, 0.76%~2.00% 세 가지 경우의 공석 반응 결과가 있음
냉각에 걸리는 시간을 아주 천천히 할 경우 경우에 따라 반응의 결과가 각각 다르므로 강을 냉각시키게 되면 강 재료를 이루는 결정의 비율이 정말 다양해짐을 추론 가능
γ 철 영역에 대해 말씀드려보겠습니다. γ 철은 다른 말로 오스테나이트 (Austenite)라고도 부르니 둘을 연관지어 꼭 외우시길 바랍니다.
이 파트에서 알아둬야할 내용
1. 강의 공석 반응 : γ 고용체 ↔ α 철 + Fe3C(시멘타이트)
강의 공석 반응은 어떤 고체가 특정 온도에서 두 종류의 고체 결정으로 변함
공석 반응이란 쉽게 말하면 고체입자가 두 종류의 고체입자로 변하는 화학반응이라고 보시면 됩니다.
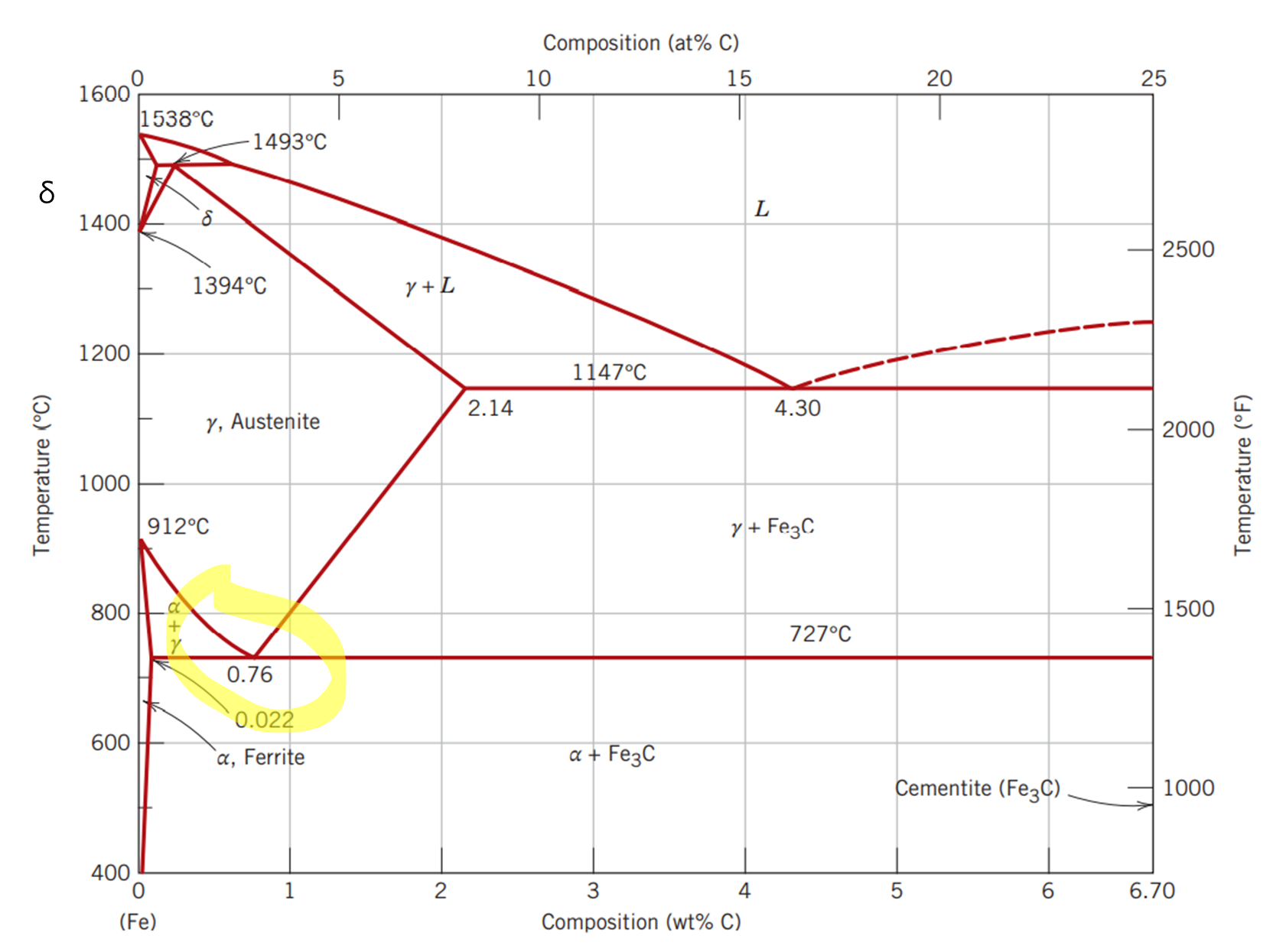
가장 중요한 부분만 표기를 했는데요. 이 부분을 알아야 강의 열처리를 이해하는 데 한 걸음 앞으로 갈 수 있기 때문입니다. γ 철 영역은 727ºC 탄소함유량 0.76% 인 부분 근처가 중요한 부분입니다. 이 부분에서 아까 위에서 언급한 공석 반응이라는 특수한 화학 반응이 발생합니다. 하지만 이 공석 반응도 세 가지 경우로 나뉠 수 있는데요.
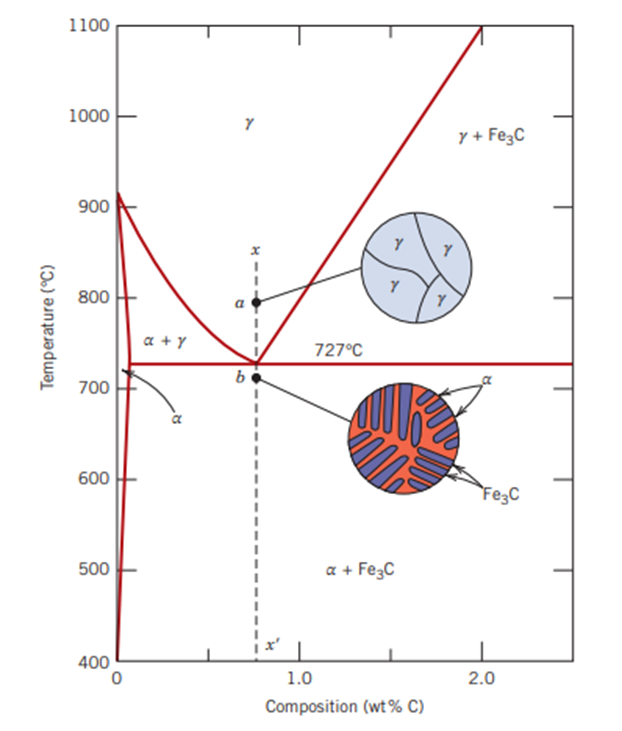
우선 첫 번째로 정확히 탄소 함유량이 0.76% 인 경우에 일어나는 공석 반응입니다. 아주 천천히 냉각을 한다고 가정하고 이야기를 해보죠. 점선 xx' 를 기준으로 보면 a 점에서는 전부 오스테나이트 상태로 있지만 b 점을 지나면서 오스테나이트가 페라이트와 시멘타이트로 변합니다. 페라이트와 시멘타이트가 같이 있는 경우를 또 펄라이트 (Pearlite) 조직이라고도 합니다. 727도씨를 기준으로 변했네요.
그럼 이제 두 번째 경우! 탄소 함유량이 0.76% 이하인 경우.. 더 정확히 말하면 0.022% ~ 0.76% 사이 인 경우 공석 반응은 어떻게 될까요? 이 경우에는 아공석 합금이란 것이 생깁니다. 아공석합금을 더 쉽게 말하면 아공석강이라고도 합니다.
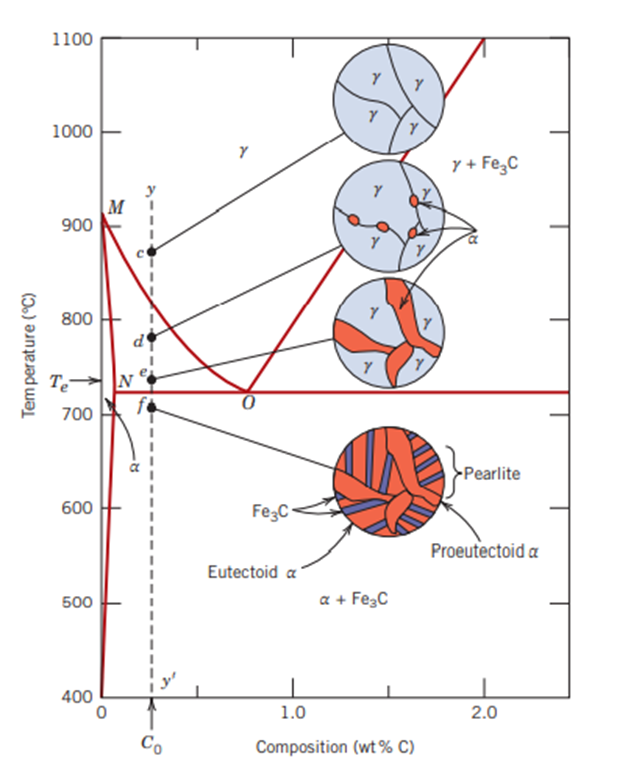
점선 yy' 위에 점 c, d, e, f 에서 어떻게 변하는지 봅시다. 일단 온도가 c 에서 e 까지 내려가게 되면 점점 페라이트 입자의 크기가 커짐을 말하고 있습니다. 그 상태에서 f 점으로 내려가게 되면 f 점에서의 그림이 조금 복잡하게 되어있지요? 그 부분을 한 번 깊게 바라봅시다.
저 그림에서 T_e 온도, 그러니까 e 점에서 f 점으로 변하게 될 경우 오스테나이트는 공석 반응에 의해 펄라이트로 변하게 될 것입니다. 이것까지는 공석점(탄소 함유량 0.76%)인 경우와 같습니다. 다만 한 가지 차이는 초석 페라이트(proeutectoid ferrite)와 공석 페라이트(eutectoid ferrite)가 표기되어 있는데요. 이렇게 생각하면 됩니다. 탄소 함유량이 0.76%인 경우에는 오스테나이트가 다른 기타 상들이 없이 펄라이트로 다 변했다면....
지금 상태는 탄소 함유량이 0.76%에서 부족한 상태인 것입니다. 이 상태는 탄소가 부족한 상태이므로 순철쪽이 더 남아돌겠지요. 그래서 순철인 페라이트 입자가 추가로 발생하게 된 상태인 것입니다.
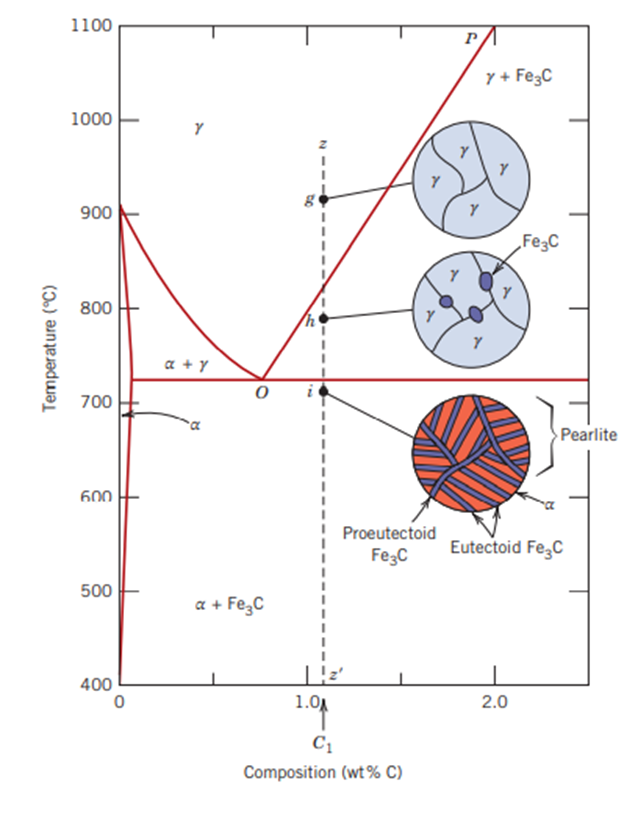
자 그럼 탄소 함유량이 0.76%~2.00%인 경우는 어떻게 될까요? 이런 경우에 생기는 공석강을 과공석합금이라고 합니다. 아공석합금과 마찬가지로 이런 경우를 또 과공석합금이라고도 합니다. 이번에는 아공석합금과 반대로 시멘타이트가 더 생깁니다. 아까 아공석강은 탄소가 부족한 쪽이라서 순철인 페라이트가 추가로 생기는 것이라고 했었습니다. 그렇다면 이 경우는 탄소 함유량이 0.76% 보다 많고, 그렇게해서 탄소를 많이 가진 시멘타이트가 공석보다 많은 상태이므로 추가로 시멘타이트가 더 생기는 것입니다. 다만 추가로 생기는 것은 하나인데요. 이걸 초석 시멘타이트 (Proeutectoid cementite)라고 합니다.
이 부분에서 알 수 있는 점은 강이 냉각되면서 강을 구성하는 결정에 여러 경우의 수가 존재함을 알 수 있습니다. 탄소가 얼마나 있느냐에 따라 오스테나이트 상태에서 냉각될 때 펄라이트만 있을지, 페라이트와 같이 있을지, 아니면 시멘타이트랑 같이 있을지... 여러 경우의 수가 있게 되는 것이죠. 이래서 목표로 하는 성능의 강 재료를 만드는 것이 어려운 것입니다.
그리고 만약 강을 냉각시키는 시간이 달라진다면 이 복잡함은 더더욱 더 복잡하게 될 것입니다. 그러므로 다음 포스팅은 강을 냉각시키는 시간을 달리 했을 때 어떠한 조직이 또 석출될 수 있는지에 대해서 말씀드려보려합니다.
반응형
'기계공학 - 이론 및 실제 > 기계공작법과기계재료' 카테고리의 다른 글
| 강의 열처리 5편 - 연속 냉각 변태도 ( Continuous Cooling Transformation diagram, CCT) (0) | 2023.01.21 |
|---|---|
| 강의 열처리 4편 - TTT 선도에 대해 공부해보자! (0) | 2023.01.14 |
| 강의 열처리 2편 - 간단한 상태도 분석! (0) | 2022.07.23 |
| 강의 열처리 1편 ! 용어 (0) | 2022.06.25 |
| 기계공작법 과목에 대한 경험담 (0) | 2021.01.18 |